VR·AR 의료기기, 소프트웨어 만으로 심사‧허가
식약처, 가이드라인 개정 내용 발표
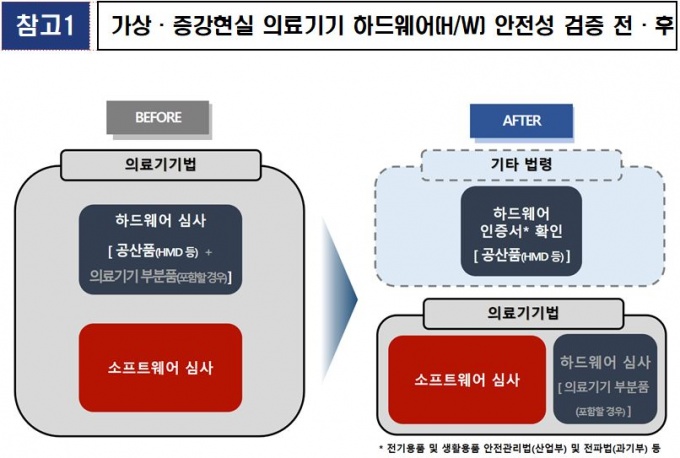
[데일리메디 박민식 기자] 식품의약품안전처가 가상현실(VR)·증강현실(AR) 의료기기와 관련해서 '의료기기 허가·심사 가이드라인'을 개정한다고 30일 밝혔다.
가상·증강현실 기술이 적용된 의료기기가 점차 증가함에 따라 해당 기기들에 대한 안전성 검증 방법을 개선하고 임상시험 대상을 명확히 하는 내용이다.
이번 개정의 주요 내용은 ▲가상·증강현실 의료기기 소프트웨어 등 심사 대상 ▲임상시험이 요구되는 사례 ▲사용자 안전을 위한 ’사용방법‘ 및 ’사용 시 주의사항‘ 기재사항 안내 등이며 업체 면담 및 옴부즈만 제도를 통해 수렴한 결과가 반영됐다.
전기를 사용하는 의료기기의 경우 전기 및 전자파 안전에 관한 자료를 의무적으로 제출해야 했으나, 가상·증강현실 소프트웨어가 ‘헤드 마운트 디스플레이(HMD)’ 및 모바일기기 등 공산품에 사용될 경우 공산품은 타 법령에 따라 발급된 안전 인증서 유무만 확인하고 의료기기에 해당하는 소프트웨어만 심사토록 개선한다.
업체가 가장 큰 부담을 느끼는 임상시험 분야와 관련해서는 임상시험이 요구되는 사례를 명확히 제시하고 새로운 장치를 사용하더라도 임상시험이 면제되는 사례를 안내한다.
의료기기 사용자 안전과 관련해서는 사용 전(前) 소독 및 환자 사용 시 주의사항 등 ‘사용방법’과 ‘사용 시 주의사항’에 반드시 기재해야 할 정보를 구체적으로 제시한다.
식약처는 "이번 가이드라인을 통해 첨단기술이 적용된 의료기기가 신속하게 허가될 수 있을 것으로 기대한다"며 "앞으로도 새로운 의료기기 특성을 반영한 안내서 등을 지속 발간할 계획"이라고 밝혔다.
한편, 자세한 사항은 식약처 홈페이지 공무원지침서/민원인안내서 코너에서 확인할 수 있다.

