
국내 연구진이 암·루게릭병 등 전령 RNA(mRNA)가 변화하는 다양한 질환에서 ‘역방향 알루 반복구조(IRAlus)’라는 새로운 발병 원인을 최초로 제시했다.
KAIST(총장 이광형)는 생명화학공학과 김유식 교수와 바이오및뇌공학과 이영석 교수 공동 연구팀이 종양 형성과 퇴행성 뇌질환을 유발하는 새로운 유전자 조절 기전을 찾아냈다고 6일 밝혔다.
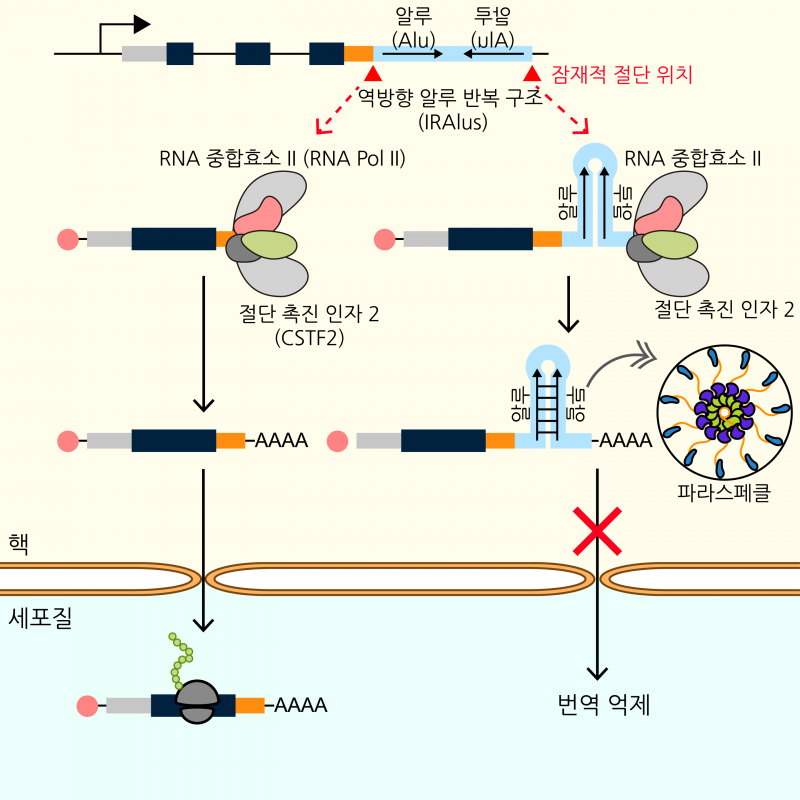
연구팀에 따르면 인간 유전체의 약 10%를 차지하는 반복서열인 알루 요소(Alu)는 단백질 정보를 가지는 mRNA의 단백질 생산 효율을 조절할 수 있다.
특히 mRNA가 2개의 알루 요소로 형성된 IRAlus를 가지게 되면 mRNA의 세포 내 이동이 방해돼 단백질 생산이 감소한다.
연구팀은 질환 특이적으로 mRNA가 변화하는 과정에서 주요 mRNA가 IRAlus에 의해 조절받게 하고, 이는 mRNA가 가지고 있는 유전자 발현 억제로 이어져 질환을 일으킨다는 것을 알아냈다.
Alu는 유전체의 단백질 정보를 가지고 있지만 유전체 상에서 본인의 서열만을 복제하는 성질이 있어 ‘이기적 서열’로 알려져 있었다.
그러나 해당 유전자 발현 조절 기전의 생물학적 중요성에 대해서는 보고된 바가 없었다.
연구팀은 IRAlus를 인지할 수 있는 항체를 활용한 차세대 염기서열 분석법을 사용해 특정 세포 내 활성화된, 기능적인 IRAlus를 가지고 있어 IRAlus에 의해 단백질 합성이 억제될 수 있는 mRNA 유전자 목록을 완성했다.
 연구팀은 “대표적인 종양억제유전자를 억제하는 종양 유전자 조절을 하고 이는 단백질 발현 증가로 이어지며 결과적으로 종양억제유전자 활성이 억제됨으로써 암 발달을 촉진할 수 있다”고 설명했다.
연구팀은 “대표적인 종양억제유전자를 억제하는 종양 유전자 조절을 하고 이는 단백질 발현 증가로 이어지며 결과적으로 종양억제유전자 활성이 억제됨으로써 암 발달을 촉진할 수 있다”고 설명했다.
연구팀은 또한 특정 혁신 RNA 치료제인 안티센스 올리고뉴클레오타이드(ASO)를 활용해 단백질 발현을 복구하는 암 치료 전략을 탐색했다.
그 결과 신경계 세포에서 IRAlus로 인한 유전자 조절이 활발하다는 것을 확인했다. 해당 현상의 과도한 활성과 루게릭병으로 알려진 근위축성 측삭경화증을 비롯한 퇴행성 뇌질환 간의 연관성도 최초로 제시했다.
김유식 KAIST 생명화학공학과 교수는 “IRAlus라는 새로운 타겟 물질을 활용하면 종양과 노화를 비롯해 다양한 퇴행성 질환의 발병 기전 분석에 근본적이고 효과적인 치료전략을 마련하는 데 유용할 것”이라고 전했다.
