 국내 개발 소프트웨어 의료기기 2개 제품이 혁신의료기기 41호와 42호로 지정됐다. 혁신의료기기로 지정되면 신속한 제품화를 위한 지원을 받을 수 있다.
국내 개발 소프트웨어 의료기기 2개 제품이 혁신의료기기 41호와 42호로 지정됐다. 혁신의료기기로 지정되면 신속한 제품화를 위한 지원을 받을 수 있다.
식품의약품안전처는 관상동맥 협착 정도를 평가하는 심혈관위험평가소프트웨어(제품명 HeartMedi)와 만성콩팥병 위험을 표시하는 병원진료용소프트웨어(제품명 DrNoon CKD)를 혁신의료기기로 지정했다고 21일 밝혔다.
에이아이메딕 ‘HeartMedi’는 흉부 컴퓨터단층촬영(CT) 영상을 토대로 관상동맥을 3차원 형상화해서 분획혈류예비력(FFR)을 전산유체역학 기반으로 계산, 협착 정도를 평가하는 국내 첫 제품이다.
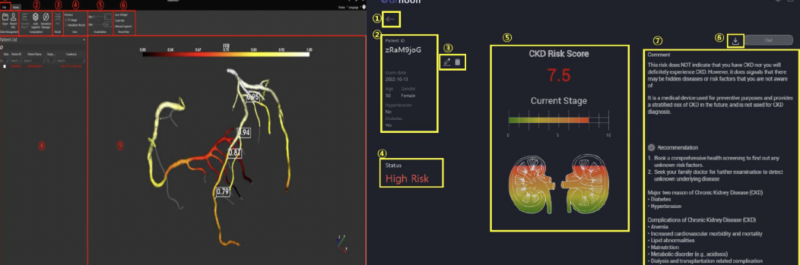
메디웨일 ‘DrNoon CKD’는 인공지능으로 망막사진에서 망막 구조와 망막 내 혈관모양을 분석해 만성콩팥병 발생을 저위험 및 중증도위험, 고위험으로 평가해주는 품목이다. 이 제품 역시 국내 최초 소프트웨어다.
현재 만성콩팥병 표준검사법은 혈액검사를 토대로 사구체여과율을 확인하는 방법을 사용하고 있으나, 이 제품의 경우 망막 사진에서 미세한 혈관 변화를 분석해 콩팥질환 발생을 예측한다.
통합심사·평가를 거쳐 혁신의료기기로 지정된 ‘HeartMedi’는 현재 품목허가를 신청, 심사가 진행 중이다.
향후 품목허가 완료 시 신의료기술평가위원회와 신의료기술 안전성·유효성 평가결과 고시 개정·공포(30일)를 거쳐 비급여로 의료현장에서 3~5년정도 사용될 예정이다.
일반심사를 거쳐 혁신의료기기로 지정된 ‘DrNoon CKD’는 현재 개발 중인 제품으로 향후 우선심사 등 허가심사 특례를 적용받을 수 있어 신속한 제품화에 도움이 될 것으로 기대된다.
식약처는 "앞으로도 혁신의료기기가 의료현장에서 널리 사용될 수 있고 국민에게 안전하고 새로운 치료 기술을 신속히 제공토록 혁신의료기기 제도를 효과적으로 운영하겠다"고 밝혔다.
