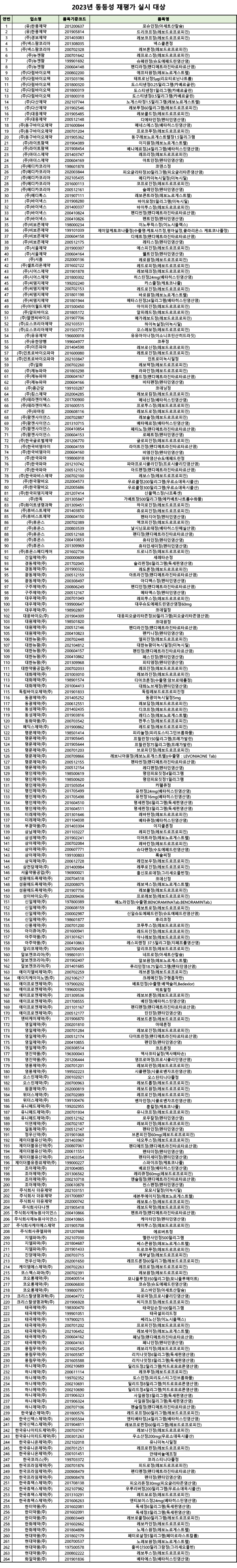
국내 기허가 품목 중 121개사 264품목에 대한 동등성 재평가가 실시된다.
5일 식품의약품안전처는 '2023년 의약품 동등성 재평가' 대상 품목과 제출 기한 등을 공고했다. 이는 약사법 제35조 및 시행규칙 24조에 따라 진행된다.
의약품 동등성 평가는 주성분, 함량, 제형이 동일한 두 제제에 대한 의약품 동등성을 입증하기 위해 실시하는 생물학적 동등성, 비교용출, 비교붕해 등을 시험하는 것이다.
이번에는 코팅하지 않고 타정한 나정 제형의 전문의약품이 주요 대상이다. 사전 예시된 품목 652개 중 대조약, 동등성 기입증 품목 등은 대상에서 제외하고 264개 품목이 시험대에 오른다.
해당 제약사는 재평가 신청서와 의약품 동등성 시험계획서를 3월 31일까지, 품목별 승인된 계획서에 따른 생물학적동등성시험 결과보고서는 12월 31일까지 식약처에 제출하면 된다.
재평가 대상으로 공고된 품목은 기한 내 자료를 제출하지 않으면 판매업무 정지 등 행정처분을 받게 되며, 향후 시험 결과 동등성을 입증하지 못한 경우 판매중지 및 회수 조치된다.
식약처는 허가자료로 동등성 입증 자료 제출을 의무화하기 이전에 허가된 품목들에 대해 의약품 동등성 재평가를 실시하고 있다.
기존에는 특정 성분 및 제형 품목을 대상으로 실시했다가 2020년 10월부터는 전(全) 성분 및 제형 품목에 대해 재평가를 진행한다.
식약처 관계자는 "시중에 유통 중인 의약품에 대한 최신의 과학 수준에서 의약품 동등성을 확인함으로써 효과적이고 안전한 의약품을 지속적으로 공급하기 위해 올해도 실시한다"고 설명했다.