 질병관리청이 감염병 병원체 검사에 정식 허가받지 않은 진단기기를 사용했다는 주장이 제기됐다.
질병관리청이 감염병 병원체 검사에 정식 허가받지 않은 진단기기를 사용했다는 주장이 제기됐다.
더불어민주당 최혜영 의원은 질병청으로부터 제출받은 ‘감염병 진단기기 개발 및 생산 용역현황’ 자료를 분석 및 공개했다.
질병청과 시도 보건환경연구원은 감염병예방법상 감염병 병원체 검사 업무를 수행하는데, 이때 진단 시약이나 키트를 사용한다.
그런데 자료에 따르면 2017년부터 2023년 8월까지 질병청이 식약처 허가 절차를 거치지 않고 주문 제작 또는 연구 용역 형태로 17개 업체에서 3.5만 회분 23.7억원 어치 진단기기를 만들어 검사에 사용한 것으로 밝혀졌다.
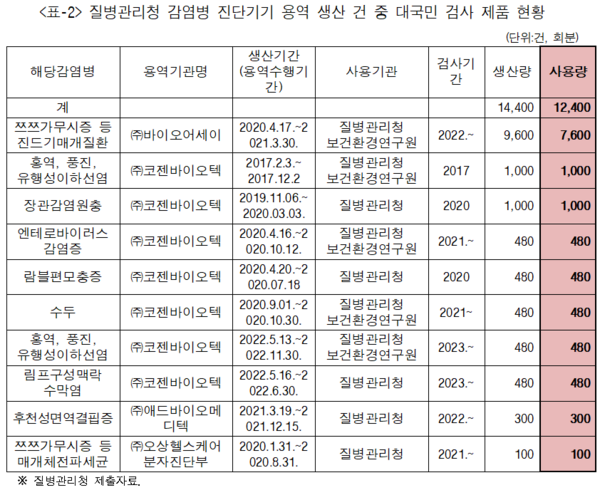
연도별로 살펴보면 2017년 조류인플루엔자 등 진단기기 5500회분, 2018년 에볼라바이러스 등 진단기기 320회분, 2019년 에볼라바이러스 등 진단기기 7505회분, 2020년 코로나19 등 진단기기 1만 7040회분, 2021년 후천성면역결핍증 등 진단기기 944회분, 2022년 엠폭스 등 진단기기 3804회분, 2023년 엠폭스 등 진단기기 300회분을 생산해 왔다.
"문제는 이렇게 생산한 진단기기들이 소관부처인 식약처 안전·품질검증없이 검사에 사용됐다"고 최혜영 의원은 지적했다. 질병청의 용역의뢰로 생산된 제품 중 일부는 질병관리청과 시도 보건환경연구원을 통해 대국민 검사에도 사용됐다는 설명이다.
대국민 검사로 사용한 제품은 쯔쯔가무시 등 진드기매개질환, 홍역, 풍진, 후천성면역결핍증 등 진단기기였으며, 1만2400회분이 사용됐다.
식약처 허가를 받은 진단기기는 체외진단기기법 및 의료기기법에 따라 시설 및 기구 및 장비를 갖춰 제조업 허가를 받아야 하고, 품질책임자를 두어야 하며 제조 및 품질관리기준을 준수해야 한다.
또 제품 오염 등 위해상황 발생 시 부작용 의무 보고와 회수와 폐기 절차를 거친다.
그러나 질병청 용역 의뢰로 만든 제품은 제품오염 등 품질 문제가 발생해도 이러한 품질관리 대상에서 제외돼 조속한 파악과 대응이 어렵다.
질병청은 법정 감염병 등 진단 시 식약처로부터 정식 허가된 제품을 구매해 사용하고 있지만, 상용화된 허가제품이 없는 경우 제조해 사용하고 있다고 답변했다.
그러나 최혜영 의원실에서 질병청과 식약처 제출자료 확인 결과, 기존 허가제품이 존재하거나 용역기간이 종료됐는데도 추가생산해 연구용역 비용보다 더 많은 금액만큼 진단기기를 생산하고 있는 제품이 존재했다.
뿐만 아니라 코로나19를 겪으며 감염병 대유행 등 공중보건위기대응 상황을 대응하기 위해 국회는 2021년 3월 ‘공중보건 위기대응 의료제품 개발 촉진 및 긴급 공급을 위한 특별법’(이하 위기대응의료제품법)을 제정했다.
법안에 따르면 식약처장이 감염병 대유행상황에 대비하는 제품을 지정하고, 필요시 감염병 검사 제품을 긴급 사용승인 및 생산명령 내릴 수 있으며, 질병관리청 등 관계부처가 이러한 사항을 위원회에서 함께 심의할 수 있다.
그런데 법 시행 이후에도 질병관리청과 식약처는 엠폭스 등 감염병 진단기기에 대해 위기대응 의료제품으로 지정하거나 위원회 심의를 거치지 않았고, 질병관리청은 법 시행 이전과 동일하게 용역의뢰를 통한 진단기기 위탁생산을 지속해 왔다.
이에 대해 최혜영 의원은 “실험실 내에서만 만들어 사용하는 시약은 식약처 허가없이 사용이 가능하지만 진단기기(키트)는 완제품으로 바로 진단에 사용할 수 있으므로 소관부처가 제품 안전성과 성능을 면밀히 검증해야 할 것으로 보인다”고 지적했다.
이어 “문재인정부와 국회가 코로나19 대응과정을 바탕으로 감염병 대유행 상황에 대비하는 국가체계를 구축한 ‘위기대응의료제품법’을 만들어 통과시켰다. 법적 근거가 마련됐는데도 질병관리청은 정해진 절차를 따르지 않고 관행처럼 감염병 진단기기들을 위탁제조하고 있다”고 말했다.
또 “새로운 법률이 제정돼 운영되고 있는 만큼 질병청이 그동안 위탁제조해 온 제품에 대해서는 긴급사용승인이나 예비 위기대응 의료제품 지정 절차를 진행해야 할 것”이라며 “향후 기존 허가제품이 없는 신종 감염병 진단기기 생산 시 부처간 역할을 명확히 해야 한다”고 강조했다.
