
 첨단바이오의약품 신약의 허가·심사 수수료가 대폭 인상된 가운데 수수료를 할인받을 수 있는 기준이 새롭게 마련됐다.
첨단바이오의약품 신약의 허가·심사 수수료가 대폭 인상된 가운데 수수료를 할인받을 수 있는 기준이 새롭게 마련됐다.
최근 식품의약품안전처는 이 같은 내용을 담은 '첨단바이오의약품 안전 및 지원에 관한 규칙 일부 개정령안'을 입법예고하고 의견조회를 진행한다.
기존에는 '중소기업자의 경우 정해진 허가·심사 수수료의 100분의 50을 감경한다'고만 돼 있던 조항에 구체적인 조건을 명시한 것이다.
우선, 신속처리 대상으로 지정된 첨단바이오의약품 중 제조업자 또는 위탁제조판매업자가 품목허가(제23조 제2항 및 제3항)를 신청한 경우다.
더불어 맞춤형 심사(제37조 제1항) 또는 조건부 허가(제38조 제1항)를 신청한 경우도 해당된다. 수입자가 수입허가를 신청하거나 맞춤형 심사 또는 조건부 허가를 신청한 경우도 포함된다.
신속처리 대상으로 지정되지 않은 첨단바이오의약품의 경우에는 법 제23조제2항 및 제3항에 따른 품목허가를 신청하는 경우에만 감경 대상이 된다.
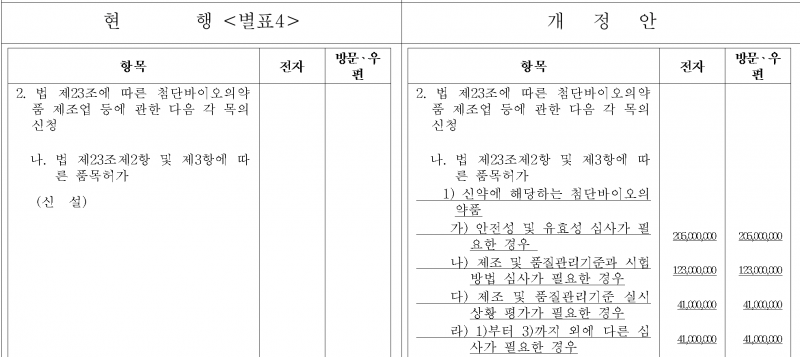
감경 조건을 충족하면 첨단바이오의약품 신약 허가·심사 수수료는 안전성 및 유효성 심사가 필요한 경우 2억500만원으로 책정된다.
제조 및 품질관리기준과 시험방법 심사가 필요한 경우 1억2300만원, 제조 및 품질관리기준 실시 상황 평가가 필요한 경우 4100만원으로 책정된다.
개정 규정은 공포한 날부터 시행되며, 이 규칙 시행 이후 신약에 해당하는 첨단바이오의약품의 품목허가를 신청하는 경우부터 적용된다.
이 규칙 시행 전에 수입자가 신약에 해당하는 첨단바이오의약품에 관한 맞춤형 심사 또는 조건부 허가를 신청한 경우에는 개정 규정에도 불구하고 종전의 규정을 따른다.
식약처 관계자는 "첨단바이오의약품의 허가 심사에 소요되는 예산의 규모를 고려해 신약인 첨단바이오의약품에 대한 허가 심사 수수료를 인상했다"고 설명했다.
그러면서 "그러나 중소기업법에 따른 중소기업자 및 희귀의약품은 제외되기에 관련 기준을 명확히 하기 위해 개정령안을 마련했다"고 덧붙였다.
한편, 이번 개정 규정에는 인체세포 등 관리업자 및 세포처리시설의 위반행위가 2개 이상일 경우 행정처분 기준도 명확히 했다.
'위반행위가 2개 이상인 경우 그 중 가장 무거운 행정처분을 적용한다'는 원칙은 동일하지만, 예외규정을 손질한 것.
'다만 행정처분 기준이 같은 업무정지에 해당하는 경우 가장 무거운 행정처분 기준에 가벼운 행정처분 기준의 2분의 1까지 각각 더해 처분할 수 있다'고 명시된 부분이 '가장 무거운 행정처분 기준에 나머지 각각의 행정처분 기준의 2분의 1을 더해 처분한다'고 바뀌었다.
 .
.
' ' .
' 100 50 ' .
, (23 2 3) .
(37 1) (38 1) . .
232 3 .
2500 .
12300, 4100 .
, .
.
" " .
" " .
, 2 .
' 2 ' , .
' 2 1 ' ' 2 1 ' . ?

