
 대웅제약이 특발성 폐섬유증(IPF) 치료제 ‘베르시포로신’ 글로벌 임상 2상에서 3차 독립적 데이터 모니터링 위원회(IDMC)로부터 ‘안전성 적합’ 판정을 받고 임상 지속 권고를 재확인했다.
대웅제약이 특발성 폐섬유증(IPF) 치료제 ‘베르시포로신’ 글로벌 임상 2상에서 3차 독립적 데이터 모니터링 위원회(IDMC)로부터 ‘안전성 적합’ 판정을 받고 임상 지속 권고를 재확인했다.
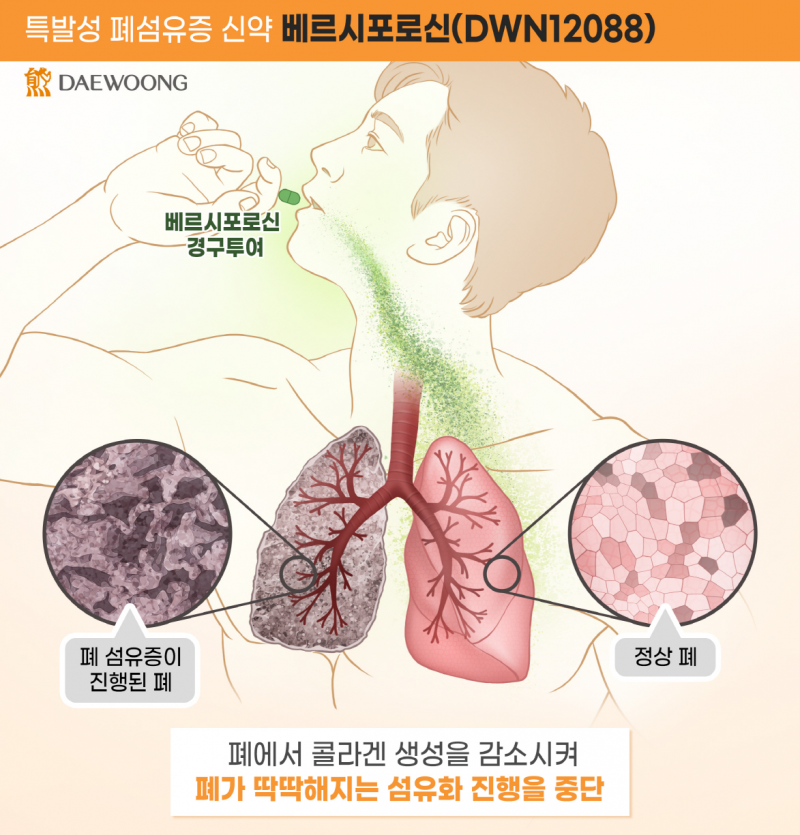
‘베르시포로신(DWN12088)’은 세계 최초로 개발 중인 신약(First-in-class)으로 희귀질환 치료제로서 글로벌 신약 경쟁 구도에 본격 진입하고 있음을 알리는 신호탄으로 해석된다.
대웅제약은 "지난달 23일 진행된 3차 IDMC 회의에서 등록 환자 89명의 중간 안전성 데이터를 정밀 검토받은 결과, 임상 중단을 필요로 하는 이상 소견이 전혀 없었다"고 27일 밝혔다.
임상 2상은 계획대로 순항 중으로 전체 목표 102명 중 94명(92%)의 환자 모집을 완료한 상태다.
임상시험은 한국과 미국 10여 개 연구기관에서 진행되고 있으며, 국내에서는 서울아산병원·삼성서울병원·신촌세브란스병원 등 권역별 상급종합병원이 참여 중이다.
IPF는 폐 조직이 점차 섬유화되며 호흡 기능이 떨어지고 생존율이 낮은 치명적 희귀질환이다. 현재 승인된 치료제는 닌테다닙과 피르페니돈 등으로, 질환 진행을 지연시키는 수준에 그친다.
베르시포로신은 콜라겐 합성 핵심 효소인 Prolyl-tRNA Synthetase(PRS)를 선택적으로 억제해 섬유화 근본 원인 자체를 차단하는 새로운 기전의 치료제다.
희귀질환 시장의 미충족 수요가 큰 IPF 분야에서 ‘First-in-class’로 상업화에 성공할 경우, 미국·유럽 등 글로벌 시장 진출 시 블록버스터급 성장 가능성이 있다는 점에서 주목받고 있다.
단독요법뿐 아니라 기존 치료제 병용요법 확장성도 임상에서 확인되고 있다.
박성수 대웅제약 대표는 “이번 3차 IDMC 결과는 베르시포로신이 안전성 측면에서 중요한 관문을 통과했다는 점에서 의미가 크다”며 “임상 2상을 차질 없이 마무리해 글로벌 희귀질환 시장에서 차세대 치료 옵션으로 자리매김할 것”이라고 강조했다.
 (IPF) 2 3 (IDMC) .
(IPF) 2 3 (IDMC) .
(DWN12088) (First-in-class) .
" 23 3 IDMC 89 , " 27 .
2 102 94(92%) .
10 , .
IPF . , .
Prolyl-tRNA Synthetase(PRS) .
IPF First-in-class , .
.
3 IDMC 2 .

