
유전자 가위(CRISPR, 이하 크리스퍼)와 약물로 동시에 암을 잡는 신약이 국내 연구진에 의해 개발됐다.
KAIST(총장 이광형)는 생명과학과 정현정 교수, 화학과 박희성 교수 공동연구팀이 유전자가위 기반 항암 신약으로 크리스퍼 단백질 및 화학 약물을 동시에 생체 내 전달하는 나노복합체를 개발했다고 3일 밝혔다.
연구팀에 따르면 암을 치료하는 방법으로 임상에서 주로 화학 약물 및 항체 치료가 사용되고 있지만 심각한 부작용 또는 반복 투여가 필요해 어려움이 있다.
이에 영구적인 유전자 조절을 일으키는 크리스퍼 기반 유전자 교정 기술을 이용하면 문제를 극복할 수 있지만, 생체 내 전달이 어려워 효과적인 전달 방법이 절실히 필요했다.
이러한 한계를 극복하기 위해 지질 나노입자, 고분자, 무기나노입자 등에 나노 전달체에 기반한 전달 방법이 개발됐지만 여전히 효능이 떨어지고 심각한 독성 및 부작용 문제가 있었다.
크리스퍼 기반 유전자 교정 기술 독성 및 부작용 문제 해결
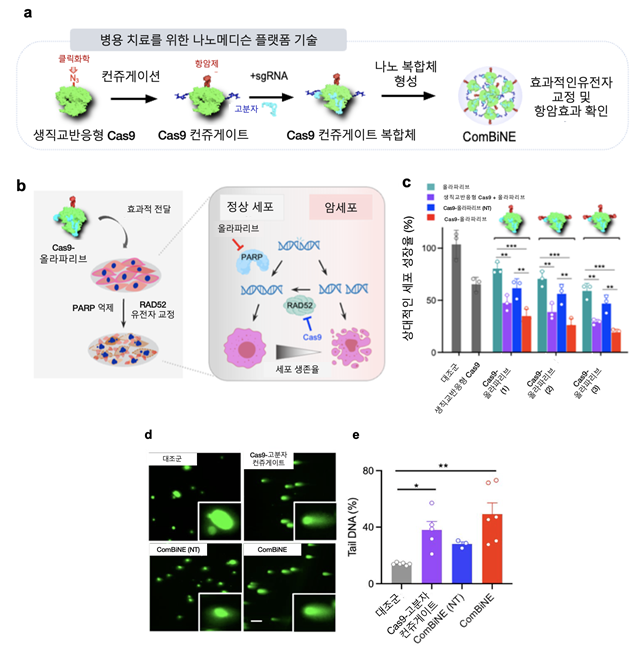 연구팀은 크리스퍼 단백질 Cas9에 서로 다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다.
연구팀은 크리스퍼 단백질 Cas9에 서로 다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다.
생직교 반응은 살아있는 시스템 내에서 본질적인 생화학 과정을 방해하지 않고 일어나는 반응이다.
연구팀은 기존 나노 전달체의 독성 및 한계를 극복하기 위해 극미량의 고분자 물질을 생직교 반응형 Cas9에 결합시켜 생체 내에 안전하게 전달 및 유전자 교정을 일으킬 수 있음을 확인했다.
또 항암 신약으로서의 효능을 극대화하기 위해 기존에 유방암 항암제로 사용되는 올라파리브(olaparib)을 생직교 반응에 의해 Cas9에 결합시켜 병용 치료를 위한 유전자가위 나노복합체인 콤바인(ComBiNE)을 개발했다.
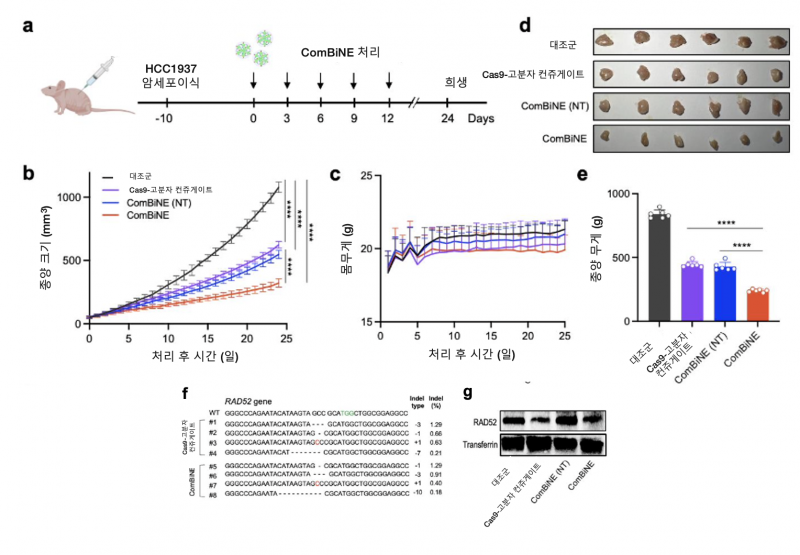 연구팀은 개발한 유전자교정 나노복합체를 이용, 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과를 확인했다.
연구팀은 개발한 유전자교정 나노복합체를 이용, 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과를 확인했다.
연구팀은 “이번 연구는 최초로 크리스퍼 단백질과 화학 항암제를 단일 제형으로 안전하고 효과적인 생체 내 유전자 교정을 일으켜 높은 항암 효능을 보였다는 점에서 큰 의의가 있다”고 밝혔다.
이어 “향후 다양한 암종에 대해 유전자 및 화학 약물 기반 병용 치료제로서 적용할 수 있는 강력한 플랫폼 기술로 활용될 것”이라고 기대감을 표했다.
한편, KAIST 생명과학과 마셀 야니스 베하 박사와 석박사통합과정 임산해 학생, 화학과 석박사통합과정 김주찬 학생이 제1 저자로 참여한 이번 연구는 국제학술지 ‘어드밴스드 사이언스(Advanced Science)'에 온라인으로 게재됐다.
