[데일리메디 양보혜 기자/국정감사] 3상 임상 조건부 허가를 받은 의약품 가운데 절반가량이 생산실적이 전무한 것으로 나타났다.
15일 국회 보건복지위원회 소속 장정숙 의원이 최근 3년간 3상 임상 조건부 허가 신청 및 통과 현황을 분석한 결과, 총 23건 중 2건을 제외한 21건(91.3%)이 허가됐다.

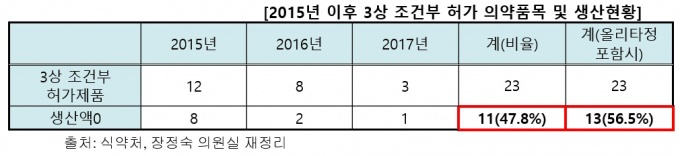
2015년 이후 제약사가 급하고 요청해 허가를 내준 조건부 허가 의약품은 23개였으며, 이중 11개(47.8%)는 현재 시점에서 생산실적이 전혀 없는 것으로 나타났다.
금년 4월 올리타정(한미약품) 200mg, 400mg도 개발 중단 계획서를 제출했기 때문에 23개 중 13개(56.5%)의 의약품이 생산, 공급을 하지 않고 있다.
허가 이후 생산이 전혀 되지 않는 제품으로는 ▲코텔릭정20mg, ▲트랜스라나과립(125mg, 250mg, 1000mg), 로스미르 등 총 5개 의약품이다.
2018년도 현재 생산이 전혀 안되는 제품은 ▲리아백스주 ▲입랜스캡슐(75mg, 125mg) ▲자이카디아캡슐(150mg) 등 4개다. 생산이 전혀 없었고 자진취소를 해버린 제품으로는 ▲자이델릭정100mg과 150mg 2개다.
또한 국산신약 개발을 독려하기 위해 마련된 제도지만 23개 품목 중 국산 신약은 단 3개(13%)에 불과했다.

장정숙 의원은 “환자 치료 때문에 허가를 빨리 내주는 특혜를 제공하고 있는데, 제약회사가 허가를 받고도 환자들에게 치료제를 공급하지 않는다면 ‘조건부 허가제’의 의미는 퇴색된다”며 “식약처는 허가 전 수요조사, 시판 후 공급계획, 사후 조건충족 여부 등에 대해 사전조사를 하고, 생산이 없는 제품은 과감히 정비해야 해야 한다”고 밝혔다.
한편, '3상 조건부 허가제도'는 생명을 위협하는 질병, 현존하는 치료법으로는 치료가 불가능한 경우(항암제, 희귀의약품 등) 환자들에게 신속한 치료기회 제공을 목적으로 도입했다.
