政, ‘규제 샌드박스’ 이행···의료벤처 등 ‘접수’
시행 첫 날 마크로젠 실증특례·엔에프 임시허가 신청
[데일리메디 고재우 기자] 정부가 신기술 및 신산업 창출을 위해 각종 규제를 면제하거나 유예해주는 ‘규제 샌드박스’를 본격 도입키로 하면서 관련 기업들의 실증특례 및 임시허가 신청이 줄을 잇고 있다.
특히 의료계에서는 보건의료 벤처기업들을 중심으로 총 3건의 신청이 있었는데, 정부는 관계부처 검토를 거쳐 30일 이내에 심의·의결을 마무리할 계획이다.
과학기술정보통신부(과기정통부)·산업통상자원부(산업부)는 17일 ‘정보통신융합법’ ‘산업융합촉진법’이 발효됨에 따라 규제 샌드박스 제도가 본격 시행된다고 밝혔다.
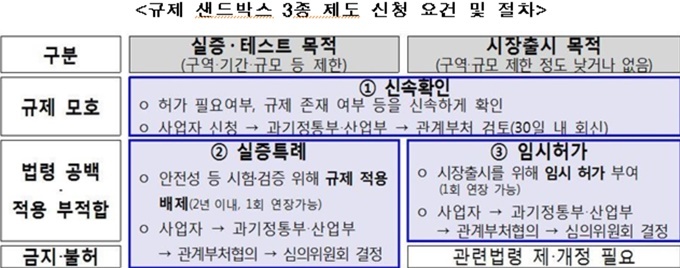
규제 샌드박스란 신기술·서비스가 국민 생명과 안전을 저해하지 않을 경우 실증특례 또는 시장출시 할 수 있도록 지원하는 제도다. 시행 첫날인 이날 과기정통부와 산업부는 총 19건의 신청을 접수했고, 이중 의료계 관련 접수는 3건이었다.
우선 과기정통부 실증특례 접수건은 올리브헬스케어의 임상시험 참여희망자 중개 온라인 서비스다. 산업부의 실증특례 접수건은 (주)마크로젠과 임시허가 접수건인 (주)엔에프다.
마크로젠 접수건이 실증특례를 판단을 받을 경우, 유전체 분석을 통한 맞춤형 건강증진 서비스가 가능해진다.
기존에는 의료기관이 아닌 유전자검사기관이 실시할 수 있는 유전자검사 허용항목은 탈모·피부노화 등 12개로 제한(생명윤리 및 안전에 관한 법률)돼 있었으나, 정부는 유전자검사 항목을 질병분야 확대여부에 대해 검토할 계획이다.
이를 통해 맞춤형 질병 예측 新서비스 창출이 가능해질 것으로 보인다.
의료기기업체인 엔에프 접수건은 기존에 산소공급장치에 의한 의료용 산소는 약제로 인정받지 못해 보험수가가 미적용된 데에 따른 건의다. 정부는 동 동 제품에서 생산된 산소의 의약품 허가 필요성을 검토해 산소공급장치 약제 인정 등으로 新의료기기 시장 창출 지원에 나선다는 복안이다.
과기정통부와 산업부는 신청 접수된 사례들에 대해 30일 이내 신기술·서비스 심의위원회(과기정통부)·규제특례 심의위원회(산업부) 등 심의·의결을 거쳐 임시허가·실증특례 여부를 결정할 방침이다.
이를 위해 과기정통부·산업부는 1월 심의위원회 위원 위촉 및 2월 중 심의위원회를 각각 개최한다.