“국내 제약사, 식약처 패싱하고 미국 FDA 직행'
김명원 의원 '신약 허가 임상시험 자진철회 5년간 300여 건'
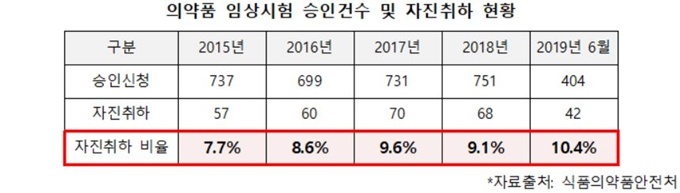
[데일리메디 고재우 기자] 식품의약품안전처(식약처)의 늦은 행정 탓에 국내 제약바이오업체들이 국내 임상시험을 포기하고 미국 FDA로 직행하는 현상이 5년간 약 300여 건에 달하는 것으로 나타났다.
6일 국회 보건복지위원회 김명연 의원(자유한국당)이 공개한 자료에 따르면 지난 2015년부터 올해 6월까지 식약처에 의약품 임상시험을 신청했다가 자진 철회한 횟수가 297건이었다.
국내 제약바이오업체 10곳 중 1곳은 국내 임상을 포기하는 셈이다.
식약처와 미국 FDA에서 수행하는 임상시험은 의약품 개발의 첫 단계다. 신약 개발에 필요한 기술과 물질을 확보한 제약바이오업체는 임상시험을 신청하는데 미국·일본·호주 등 해외에서는 의약품 임상시험 시작되는 ‘승인’까지 한 달 정도 걸리는 반면, 식약처는 1년 넘게 지체되기도 한다.
최근 3년 동안 식약처의 임상 승인이 가장 늦게 떨어진 경우는 421일이었고, 임상 1상을 승인받기까지 최대 303일 지체된 사례도 있었다.
임상 1상은 전(全) 임상시험 과정 전체에서 가장 간단한 과정임에도 국제기준에 비춰 봤을 때 식약처 임상에 과도한 기간이 소요되고 있다는 것이다.
이의 원인으로는 의약품 심사 인력이 충분히 확보되지 않는 점이 지목된다. 식약처는 의약품 심사를 정상적으로 수행하기 위해 투입돼야 하는 의사 정원을 25명으로 분석하고 있으나, 현재 재직 중인 의사는 11명으로 절반 이상 미충원 상태다.
이에 따라 의약품 심사 속도 저하로 인한 지연은 물론 심사의 질 하락에도 영향을 미친다는 지적이다.
김 의원은 “머지않아 블록버스터급 국산 신약을 만들겠다는 대통령의 공언과는 반대로 식약처는 신약 개발 첫 걸음인 임상 승인마저 제대로 수행하지 못 하고 있다”며 “신약 심사인력을 확보하고 미숙한 행정 관행을 개선해 국내 신약개발 활성화에도 기여해야 한다”고 강조했다.

